
|
|
HIPOCLORITO SODICO
Características, concentraciones y riqueza Equipos Dosificadores Ficha de seguridad Generador de hipoclorito sádico in situ
Características, concentraciones y riqueza El hipoclorito sódico es el derivado del cloro más frecuentemente empleado en la desinfección del agua de pequeños abastecimientos. Como antiséptico el hipoclorito sódico se empleo por primera vez a gran escala en la desinfección de residuos tras una epidemia de fiebre tifoidea en 1897 en Inglaterra. La fabricación del hipoclorito sódico tiene lugar al reaccionar el cloro con hidróxido sódico:
Cl2 + 2NaOH = ClONa + ClNa + H2O La riqueza o concentración de una solución de hipoclorito suele expresarse tanto en función del contenido de este, como del contenido de cloro activo ya sea en gramos por litro o en %. El cloro activo de un producto clorado es la medida de su poder oxidante expresada como cloro. Para el caso del hipoclorito sódico, se puede por tanto decir que, es la cantidad de cloro puro, en solución acuosa, que tiene el mismo poder oxidante que una cantidad determinada de hipoclorito. Como se observa en las siguientes reacciones:
Cl2 + H2O ® ClH + ClOH ® 2ClH + O
ClONa ® ClNa + O (Oxigeno naciente) Una molécula de ClONa tendrá el mismo poder oxidante que una molécula de Cl2 y por tanto el contenido en cloro activo del hipoclorito sódico puro es la relación de sus pesos moleculares : 71 / 74,5 = 0,953 = 95,3 % El peso de cloro activo o útil se determina por análisis. Conocido este contenido de cloro en gr./l. de la solución de hipoclorito, se puede pasar a % en peso de cloro activo, dividiendo este resultado por el producto 10 x densidad de la solución, es decir:
gr./l. de cloro % de cloro (en peso) = ¾¾¾¾¾¾ 10x densidad sol.
El contenido o peso de hipoclorito sódico en gr./l. de una solución de este, se calcula convirtiendo los gr./l. de cloro activo en su equivalente como hipoclorito sódico, para ello basta con multiplicar por la relación de sus respectivos peso moleculares (74 / 71 = 1,05): grs./l. de hipoclorito sódico = grs./l. de cloro útil x 1,05.
De la misma forma se haría para expresarlo en %. La densidad relativa de una solución de hipoclorito al 5,5 % en peso de cloro, es del orden de 1.1 ( a 20 ºC) y el pH = 11, mientras que la de la solución más concentrada comercialmente en uso (13 % ), es de 1.24 y el pH =13. La concentración de esta ultima solución, en gramos de cloro activo por litro será : 1.240 x 0.13 = 161 gr. aprox. En la siguiente tabla se representa la relación entre riqueza y densidad de las soluciones de hipoclorito sódico, considerando que se parte siempre de soluciones no degradadas.
El hipoclorito sódico es inestable, por lo que se prepara en solución acuosa de concentración limitada, la solución va perdiendo cloro a un ritmo mensual del 2 al 4 %, perdiendo aún más si la temperatura es mayor de 30 ºC. En los dos gráficos siguientes se muestra la degradación en función del tiempo y la temperatura
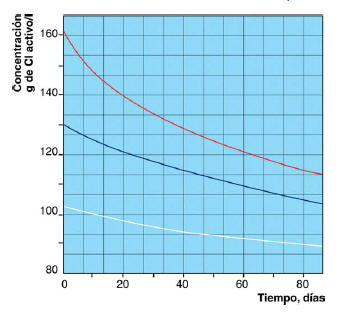 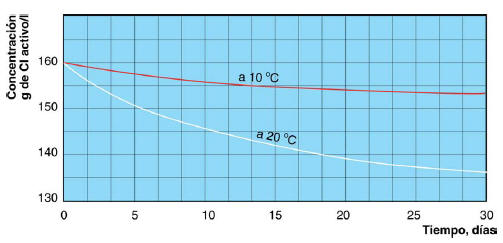 DEGRADACION DEL HIPOCLORITO SODICO EN FUNCION DEL TIEMPO Y LA TEMPERATURA
El calor, la luz, el contacto con ácidos y ciertos metales, lo descomponen en cloro gas, ácido hipocloroso y ácido clorhídrico. La descomposición suele ser según la reacción :
2 ClONa ® 2ClNa + O2 En su descomposición puede llegar a formarse clorato: 3ClONa ® 2ClNa + ClO3Na Por otra parte los iones bromuro que pueden estar presentes en las materias primas empleadas en la fabricación del hipoclorito sódico, así como el bromo que puede acompañar al cloro, se pueden transformar en bromato, debido el elevado pH del hipoclorito. Dada la limitación reglamentaria para los bromatos, es de suma importancia emplear hipoclorito sódico con certificado de calidad. Para la dosificación del hipoclorito hay que tener presentes las características especiales del producto (se muestran en la adjunta Ficha de Seguridad Química del INSHT). Se muestran igualmente a continuación varios esquemas de equipos dosificadores Equipos dosificadores
Source: Water Plant Operation, Volume 1, California State University, Sacramento,CA
GENERADORES DE HIPOCLORITO SODICO IN SITU
La generación
del hipoclorito sódico in situ es un proceso simple que se viene realizando
desde hace bastantes años. Es los últimos años con el desarrollo de ánodos
especiales de bajo consumo energético se ha extendido más su empleo. La tecnología de los generadores de hipoclorito sódico in-situ es muy sencilla, se trata de un fenómeno de electrólisis del agua salada es decir cir el paso de electricidad entre el ánodo y el cátodo inmersos en una solución de cloruro sódico de forma que el H2O y el ClNa reaccionan y forman el ClONa, liberando hidrógeno en el cátodo. Es practicamente la misma técnica que se emplea para la obtención del cloro gas. La producción de desinfectante en el mismo lugar de tratamiento, por medio de celdas electrolíticas va teniendo cada día mayor aceptación en el tratamiento del agua de consumo humano en pequeños abastecimientos La solución de hipoclorito se obtiene mediante la electrólisis de una solución de salmuera preparada con cloruro sódico. La descomposición de la solución de cloruro de sodio se efectúa por medio de una celda electrolítica con dos electrodos el cátodo está compuesto de titanio y el ánodo de titanio recubierto por óxidos de metales nobles como platino, iridio y rutenio. El proceso de descomposición se desarrolla, en cada uno de los electrodos, de acuerdo con las siguientes reacciones:
El cloro se
genera en el ánodo mientras el cátodo produce hidrógeno así: 2H2O+2e----------->H2+2OH- Cl2 + H2O ---------> HOCL + H+ + Cl-
(Sal + Agua + Energía = Hipoclorito Sódico + Hidrógeno)
ClNa + H2O + 2e = ClONa + H2 Esquemas de generación in situ de hipoclorito sódico (Fluidquip Australia) y de OSEC
El hipoclorito sódico se puede preparar en forma anhidro, con una pureza superior al 90%, pero se descompone con facilidad. En vista de su inestabilidad, se encuentra más comúnmente en solución acuosa. Las soluciones de hipoclorito sódico suelen prepararse en dos concentraciones: blanqueadores de uso doméstico, que contienen entre 5 y 5.5% de cloro disponible, y soluciones fuertes o comerciales, que contienen entre 12 y 15% de cloro disponible). Las soluciones de hipoclorito sódico se descomponen de dos formas: una en cloruro sódico y oxígeno: 2NaOCl → 2NaCl +O2 Y otra por desproporcionamiento a cloruro sódico y clorato de sódico: 3NaOCl → 2NaCl + NaClO3 Esta ultima reacción tiene lugar en dos pasos: un paso lento inicial en que se forma el clorito sódico 2NaOCl → NaCl + NaClO2 y un paso rápido de desproporcionamiento entre el hipoclorito y el clorito : NaOCl + NaClO 2 → NaCl + NaClO3
El hipoclorito sódico puede reaccionar también con ácido hipocloroso: 2NaOCl + HOCl → 2NaCl + HClO3 En medio ácido, el hipoclorito se descompone con mayor facilidad que en medio básico, es por ello que las soluciones de hipoclorito de sodio se mantienen a pH 11 a 12. El agua de mar que tiene una concentración del orden de 19,9 mg./l de ión cloruro( equivalente a 31,2 mg./l de ClNa), se puede emplear como fuente de este ión en la fabricación electrolítica de hipoclorito. Un inconveniente al emplear agua de mar es la formación de incrustaciones en la superficie del cátodo debido al alto contenido de iones que producen dureza lo que haría necesaria la interrupciones y limpiezas con soluciones ácidas. Una gran ventaja de la generación in situ de hipoclorito es la facilidad de su generación y que se elimina el peligro del almacenaje y manejo de las soluciones de hipoclorito comercial y a la vez se evita la degradación que con el tiempo experimentan las soluciones comerciales de hipoclorito del 15 % y la consiguiente formación de clorato en esta degradación. También hay que tener en cuenta que el hipoclorito comercial del 15 % tiene un elevado pH que puede llegar a influir en la precipitación de carbonato cálcico cuando se mezcla con el agua para obtener soluciones más diluidas, formandose incrustaciones en conducciones, válvulas, rotámetros, etc. USO DE HIPOCLORITO (LEJÍA) PARA DESINFECTAR EL AGUA DE CONSUMO DOMÉSTICO Conociendo el volumen del agua a desinfectar y la concentración o riqueza en cloro del hipoclorito o lejía, se calculará la cantidad de lejía a emplear, la lejía a utilizar debe ser APTA PARA LA DESINFECCIÓN DEL AGUA DE CONSUMO . El tiempo de contacto debe ser de 30 minutos. El contenido final de cloro libre debe oscilar entre 0,2 y 1,0 mg/litro En la tabla siguiente se exponen las cantidades del desinfectante a emplear en función de la concentración de este y el volumen de agua a tratar:
Fichas seguridad del hipoclorito.PDF
Ficha Internacional de Seguridad Química del Hipoclorito Sódico
Bromato en el hipoclorito sódico.
Clorato en el hipoclorito sódico Variabilidad de los niveles de clorato en el hipoclorito sódico. FICHA DE DATOS DE SEGURIDAD DEL HIPOCLORITO.De acuerdo al Reglamento (CE) No. 1907/2006. Fecha de revisión 09.11.2017 Versión 18.0. Publicación de MERCK | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||