|

CLORACION
Introducción
. Factores que influyen en
la cloración . Reacciones del
cloro en el agua
Demanda de cloro y break point .
Cloro residual en la red
de distribución
Equipos e instalaciones de cloración .
Absorción y
neutralización del cloro en caso de fugas .
Enlaces
relacionados con el cloro . Ensayos de
cloración
Introducción
Es ampliamente conocido
el hecho de que las grandes epidemias de la humanidad han venido por la vía
de la contaminación del agua. y aunque en la actualidad han sido
prácticamente dominados estos problemas, no quiere decir que hayan
desaparecido los peligros que las diferentes contaminaciones del agua pueden
originar. Es este el principal motivo que impulsa a aplicar continuamente
los procesos técnicos más actuales y el empleo de nuevos productos, para
conseguir mediante el tratamiento adecuado, un agua de calidad sanitaria
óptima, teniendo en cuenta que el agua, en sus diferentes fuentes de
captación, está cada vez más deteriorada.
En
el proceso de oxidación de las diferentes sustancias presentes en el agua y
su esterilización, el producto más ampliamente utilizado es el cloro ( en
los pequeños abastecimientos se suelen emplear derivados del cloro).Si bien
en algunas aguas no llega a lograrse el objetivo deseado, dada la presencia
de diversas sustancias, con las que el cloro no es tan efectivo, o bien a
que precisamente el cloro conduce en su reacción con otras sustancias
orgánicas a la formación de compuestos orgánicos clorados muy cuestionados
por su potencial perjuicio para la salud (por ejemplo los trihalometanos).
Estas circunstancias han llevado a la utilización de otros productos, que si
bien no le sustituyen completamente, sí lo complementan, entre los que
destacan principalmente el dióxido de cloro y el ozono.
No
vamos a exponer las características físico-químicas del cloro, pero habrá
que tener presente que, para su eficaz y seguro manejo, hay que partir del
conocimiento de todas ellas.
La aplicación del cloro,
directamente como tal, data de 1912 en EE.UU. En 1913, Wallace y Tiernan
introducen unos equipos que permiten medir el cloro gas y formar una
solución concentrada que es la que se aplica al agua a tratar. Desde
entonces la técnica de la cloración se ha ido perfeccionando y ampliando su
adopción como práctica habitual en la desinfección del agua La
esterilización es una de las principales fases del proceso de tratamiento
del agua. Empleando el cloro en este proceso se contemplan dos etapas:
precloración, realizada antes de la fase de coagulación-floculación, y
poscloración o esterilización, que suele ser la última etapa del
tratamiento.
Aún
cuando el principal objetivo de la cloración comenzó siendo, y aún lo es, la
destrucción de gérmenes, dado su gran poder bactericida, no debe olvidarse
que su elevado poder oxidante origina otros efectos también muy importantes,
como pueden ser la contribución a la eliminación del hierro y manganeso,
eliminación de sulfhídrico, sulfuros y otras sustancias reductoras,
reducción de sabores existentes antes de la cloración o bien producidos por
los compuestos de adición formados por el cloro, impedir el crecimiento de
algas y otros microorganismos que interfieren en el proceso de
coagulación-floculación y filtración, mantener los lechos filtrantes libres
de posibles crecimientos de bacterias anaerobias, reducción del color
orgánico, etc.,
La desinfección del agua y más concretamente la
cloración, está siendo objeto de polémica en los últimos años, como
consecuencia, principalmente, de los subproductos de la desinfección,
llegando a cuestionarse la necesidad de la propia desinfección en muchos
casos. Las reglamentaciones de los países difieren bastante a este respecto,
algunos incluso no requieren de forma expresa el empleo de desinfectantes en
el tratamiento del agua, si bien es cierto que las calidades de las aguas en
origen son muy distintas y más aún entre los diferentes países.
La reciente Directiva Europea relativa a la calidad de
las aguas destinadas al consumo humano, no requiere de una forma directa el
empleo de desinfectante, ni el mantenimiento de éste en la red de
abastecimiento. La Directiva fija unas características microbiológicas
mínimas que los distintos países miembros deberán mantener, siendo por tanto
éstos los que decidirán el empleo o no de desinfectante para cumplir con los
valores paramétricos exigibles.
Muchos países, dentro y fuera de la UE, debido a las
características de sus aguas, generalmente superficiales, acuden a la
desinfección, principalmente con cloro y mantienen una determinada
concentración de residual en sus redes de distribución. Esta desinfección
puede traer consigo la generación de sustancias perjudiciales para la salud
de los consumidores, conocidas como subproductos de la desinfección, con
valores máximos fijados en la propia Directiva, y que han sido a veces el
motivo para no emplear desinfectante o al menos replantearse su empleo. En
cualquier caso, como la misma Organización Mundial de la Salud indica, no se
debe comprometer o dejar en segundo término, una correcta desinfección, ante
los efectos a largo plazo que originarían los subproductos de la
desinfección. A la cloración del agua se puede atribuir el 50 % del
aumento de la esperanza de vida del siglo XX
Como quiera que en las redes de los sistemas de
distribución es necesario, y a veces obligatorio en algunos países, el
mantenimiento de un desinfectante residual, en este artículo se expone y
analiza en su parte final, el empleo de las cloraminas como desinfectante
secundario (postdesinfección), para mantener durante más tiempo una
determinada concentración de cloro residual combinado en el sistema de
abastecimiento, y a la vez, dado que las cloraminas penetran más en el
biofilm interno de la red, inactivar los microorganismos e inhibir su
crecimiento.
Por otra parte, el empleo
de las cloraminas genera menos subproductos de desinfección y presentan
menos tendencia que el cloro a provocar olores y sabores en el agua tratada,
sin olvidar algunos problemas ligados al empleo de las cloraminas,
destacando principalmente los fenómenos de nitrificación
PROPIEDADES DEL CLORO
Color: Amarillo verdoso.
Olor: Sofocante.
Peso atómico: 35,457.
Peso molecular: 70,914.
Número atómico: 17.
Densidad del gas respecto del aire: 2,49.
Un litro de cloro gas (0 °C, 1 atm) pesa: 3,214 g.
Un kg de cloro gas (0 °C, 1 atm) ocupa: 311 I.
Un volumen de cloro líquido al vaporizarse origina: 457,6 volúmenes de
gas.
Temperatura de ebullición (1 atm): - 34,1 °C.
Temperatura de congelación (1 atm): - 101,0 °C.
Viscosidad del gas a 20 °C: 0,013 centipoises.
Viscosidad del líquido a 20 °C: 0,34 centipoises.
Calor específico:
Gas (a 1 atm, 0 °C-100 °C):
Cp: 0,124 kcal/kg. °C.
Cv: 0,092 kcal/kg. °C.
Líquido (0 °C-24 °C) 0,226 kcal/kg. °C.
El «cloro seco» (entendiendo por tal el que contiene menos de 100 mg de
agua por metro cúbico) es relativamente estable. A temperatura inferior a
100 °C no ataca al cobre, hierro, plomo, níquel, platino, plata, acero y
tántalo. Tampoco reacciona con algunas aleaciones de cobre y hierro, como «Hastelloy»,
«Monel» y numerosos tipos de aceros inoxidables.
El «cloro húmedo», por el contrario, es muy reactivo. Prácticamente ataca
a todos los metales usuales. No así al oro, platino, plata y titanio. A
temperaturas inferiores a 149 °C el tántalo es inerte al cloro, bien sea
seco o húmedo. Lo resisten bien algunas aleaciones de ferrosilicio.
Factores que influyen en la cloración
Entre los principales factores que influyen en el proceso de desinfección y
tratamiento del agua con cloro, figuran los siguientes:
-Naturaleza, concentración y distribución de los organismos que se van a
destruir, así como de la concentración y distribución de la sustancia
desinfectante y de los productos de su reacción con el agua, así como de las
sustancias disueltas o en suspensión presentes en el agua.
-Naturaleza y temperatura del agua objeto del tratamiento.
-Tiempo de contacto entre el cloro y el agua.
-Ph
del agua.
Respecto a los anteriores factores, podemos decir, en lo que respecta a los
organismos presentes en el agua, que estos pueden ser muy diversos y con
unos requerimientos de cloro para su eliminación muy diferentes.
En el proceso de cloración y en la desinfección en general,
las variables usualmente más controlables son:
1)
La naturaleza y concentración del
desinfectante
2)
El tiempo de contacto entre el desinfectante
y los microorganismos
3)
La mezcla, dispersión y grado de agitación
del agua.
Para que la cloración resulte eficaz es necesaria una distribución homogénea
del cloro en el agua y que la dosis sea adecuada, para obtener un agua
tratada inocua. A partir de 0,1 a 0,2 ppm. de cloro libre residual en el
agua, ya se percibe sabor, percibiéndose antes cuanto mayor sea la dureza y
temperatura del agua. Puede procederse a la decloración o eliminación del
cloro en el agua, mediante el empleo de sustancias reductoras, tales como
el anhídrido sulfuroso, el hiposu1fito sódico, etc.,. Utilizando cantidades
apropiadas de estos productos se puede eliminar la cantidad de cloro
deseada. También se puede eliminar el cloro filtrando el agua a través de
carbón activo.
Entre las múltiples sustancias que pueden contener las aguas naturales,
algunas influyen en gran medida en la eficacia de la cloración. Por ejemplo,
en presencia de sustancias orgánicas, la acción desinfectante del cloro es
menor. El amoníaco y otros compuestos orgánicos nitrogenados consumen cloro.
El hierro y el manganeso reaccionan con el cloro aumentando la demanda de
éste, y, una vez oxidados, contribuyen a aumentar la turbiedad del agua.
Las
bacterias y virus pueden quedar protegidos de la acción del cloro por los
sólidos suspendidos en el agua; de aquí que la eficacia de la cloración se
vea aumentada mediante la subsiguiente filtración y una posterior
esterilización.
Respecto a la temperatura, la eficacia de cloración aumenta al aumentar
aquélla, naturalmente siempre que las demás condiciones permanezcan
invariables. A pesar de esto, ocurre que como en el agua a baja temperatura
el cloro permanece más tiempo, puede llegar a compensarse la mayor lentitud
de la desinfección con la mayor duración del cloro en el agua.
El
tiempo de contacto es otro factor importante a tener en cuenta, ya que
durante este tiempo tienen lugar las reacciones entre el cloro y el agua y
las sustancias en ella presentes. El tiempo de contacto mínimo suficiente
para una cloración eficaz es, a su vez, función de la temperatura, pH,
concentración y naturaleza de los organismos y sustancias presentes en el
agua, así como de la concentración y estado en que se halle el cloro. Como
mínimo, el tiempo de contacto deber de ser de diez a quince minutos.
Para que la acción de un desinfectante sea eficaz, hay que mantener una
determinada concentración del desinfectante durante un período de tiempo,
es decir, la expresión C.t, representaría la concentración del
desinfectante final en mg./l. (C) durante el tiempo mínimo de exposición en
minutos (t ). La expresión que nos muestra el efecto de la concentración
del desinfectante sobre la velocidad de destrucción de bacterias, se expresa
más correctamente por Cn . t = Constante.
El
exponente n para el cloro varía entre 0.5 y 1.5, dependiendo de la
temperatura y del pH
El
pH juega un papel de suma importancia y nos detendremos en él cuando
tratemos de las reacciones del cloro en el agua. Por ahora diremos que el
poder bactericida del cloro es menor para un pH superior a 7, que para otros
valores de pH más bajos a éste.
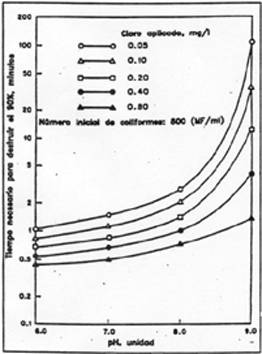
El tiempo de contacto
para lograr un determinado grado de desinfección disminuye al aumentar la
concentración y tambien como se acaba de indicar, al disminuir el pH. En el
gráfico siguiente se observa lo indicado, relacionando el tiempo de contacto
necesario para destruir el 90 % de coliformes a diferentes pH.
Reacciones del cloro en el agua
Las reacciones que
tienen lugar entre el cloro y el agua, aunque en principio parecen muy
simples, no siempre lo son, ya que el agua objeto de la cloración no sólo
es H2O, sino que en ella hay diversas sales y materias orgánicas en
solución y suspensión. Pero trataremos en principio sólo de las reacciones
de equilibrio que tienen lugar al reaccionar el cloro con el agua,que son
reacciones de hidrólisis , se originan ácidos hipocloroso y clorhídrico :
CL2
+ H2O ↔ CLOH + CLH (1)
El ácido
clorhídrico es neutralizado por la alcalinidad del agua y el ácido
hipocloroso se ioniza, descomponiéndose en iones hidrógeno e iones
hipoclorito:
CLOH
↔
H+ + CLO-
(2)
La constante de ionización del anterior
equilibrio es:
[ H+] *
[CLO-]
----------------------- = Ki (3)
[ CLOH
]
La constante
de ionización K1 varía con la temperatura como se indica en la siguiente
tabla:
|
Temper. ºC |
0 |
5 |
10 |
15 |
20 |
25 |
|
(Moles/l) Ki |
1,5.10-8 |
1,5.10-8 |
2,0.10-8 |
2,2.10-8 |
2,5.10-8 |
2,7.10-8 |
La constante de hidrólisis de la reacción (1) es de tal orden que no
existe en el agua una concentración apreciable de CL2 a no ser que la
concentración de H+ sea elevada, es decir, que el pH del agua sea
bajo, menor de 3, y haya una concentración total de cloruros mayor de 1.000
mg/l.
A las
temperaturas ordinarias del agua, la hidrólisis del cloro es prácticamente
completa en algunos segundos y la ionización del ácido hipocloroso es una
reacción reversible instantánea. El sentido de esta reacción, es fácil ver
que se encuentra dirigido por la concentración de iones hidrógeno, es decir
del pH. Por tanto, se puede decir que según sea el pH del agua, se obtendrán
unos porcentajes diversos de CLOH y CIO- , porcentajes que pueden
calcularse mediante la ecuación (3) y la tabla anterior en la que figuran
los valores de Ki partiendo de la relación:
[ClOH] [CIO-]
—————————- = 1 ÷
( 1 + ————-) (4)
[ClOH
] [ClO-] [ClOH]
[CLO-]
Ki
Y deduciendo de la ecuación (3) que:
--------------- = ----------
[CLOH] [H+]
[CLOH] Ki
sustituyendo en (4), resulta : -------------------------- = 1 ÷ ( 1 +
----------) (5)
[CLOH] + [CLO-]
[H+]
Por ejemplo a 20 º C y pH = 7 , el porcentaje de
ClOH será según (5) :
1
_______________________ ; de donde CLOH = 80 %
2,5 .
10-8
1+ --------------
10-7
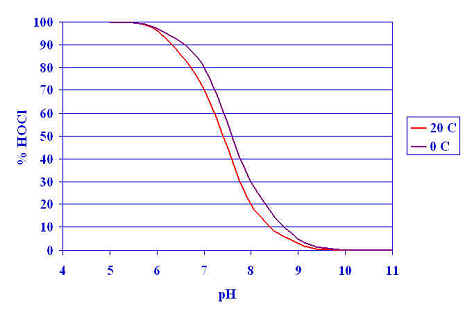
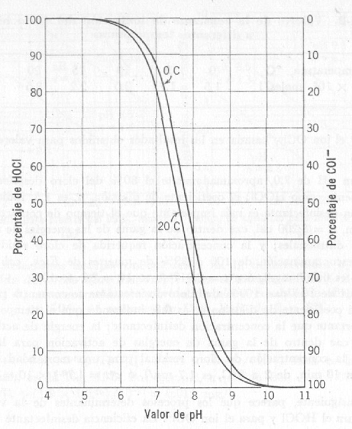
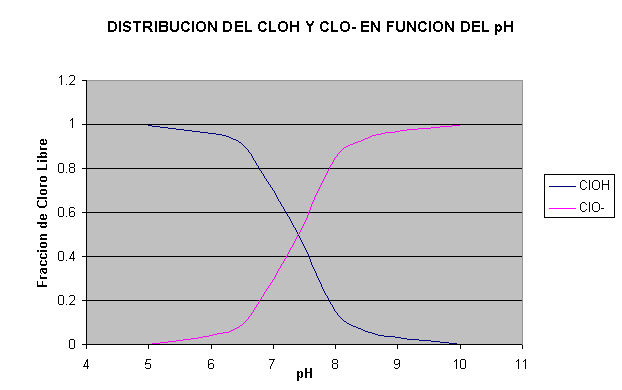
Fig. 1
1.b) Distribución del ClOH y ClO- en función del pH
En las figuras 1.a) y 1.b) se muestran los
porcentajes de distribución de ClOH y ClO- , o sus fracciones
expresadas en cloro libre, a varios pH calculados como en el
ejemplo anterior. Entre pH 6 y pH 9.5, hay equilibrio entre el ácido
hipocloroso sin disociar y disociado. Para pH mayor de 9.5, está
prácticamente todo el ácido hipocloroso disociado en ión hipoclorito.
En forma de tabla se recoge a
continuación:
Distribución de
OCl- y
HOCl en
función del
pH del
agua
|
pH |
OCl-
(%) |
HOCl
(%) |
|
5,5 |
0,23 |
99,77 |
|
6 |
0,46 |
99,54 |
|
6,5 |
1,45 |
98,55 |
|
7 |
4,46 |
95,54 |
|
7,5 |
12,86 |
87,14 |
|
8 |
31,82 |
68,18 |
|
8,5 |
59,61 |
40,39 |
|
9 |
82,36 |
17,64 |
|
9,5 |
93,65 |
6,35 |
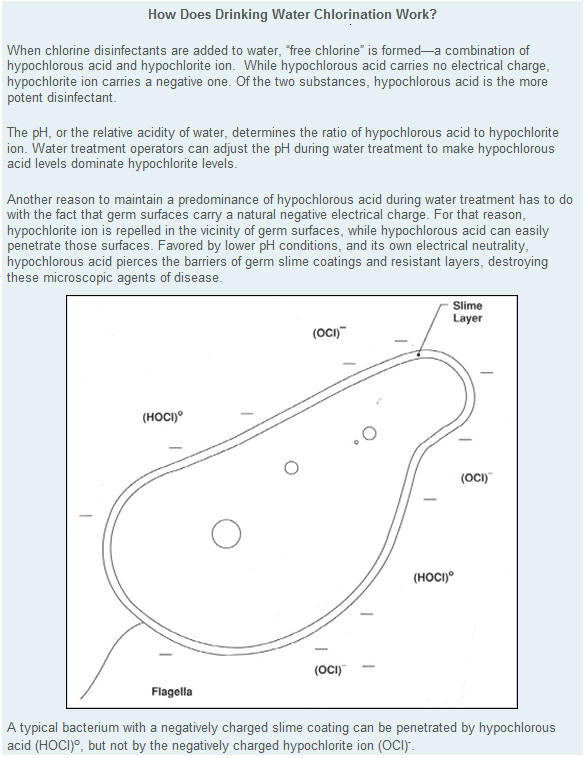
El ácido hipocloroso tiene mayor poder
oxidante y bactericida que el ión hipoclorito, razón esta que es muy
importante tener en cuenta, ya que, como hemos visto, la proporción de ácido
hipocloroso e ión hipoclorito es función del pH, debiendo operarse, a ser
posible, al pH más idóneo para lograr una más eficiente desinfección.
La eliminación de bacterias y otros
microorganismos, disminuye por tanto al aumentar el pH, La eliminación de
bacterias y otros microorganismos, disminuye por tanto al aumentar el pH, así
por ejemplo en el rango de pH 7 a 8, la velocidad de
destrucción disminuye unas 5 veces al pasar de pH 7 a pH 8 , por lo que
para mantener el mismo ritmo de destrucción de bacterias , la concentración
de cloro debe mantenerse 5 veces más alta. El hecho de que la concentración
de ClOH disminuya al aumentar el pH no supone que disminuya el contenido de
cloro libre, sino que la velocidad de reacción es menor.
Teniendo en cuenta que la relación entre las
concentraciones de HClO (ácido hipocloroso) y ClO- (hipoclorito)
permanecen constante siempre que se mantenga el pH, si una porción de ácido
hipocloroso se consume en la oxidación de la materia orgánica y en la
destrucción de las bacterias, parte del hipoclorito se combinará con los
iones H+ para formar ácido hipocloroso para mantener la relación
de concentraciones entre ambos. Lógicamente, se producirá una disminución
del cloro libre.
Por otra parte hay que tener presente que la eficacia relativa de los
distintos desinfectantes que pueden emplearse en la desinfección del agua, a
igualdad de factores tan importantes, como el pH y la temperatura, es muy
diferente. En el siguiente gráfico de la figura 2 se muestran estas
diferencias.
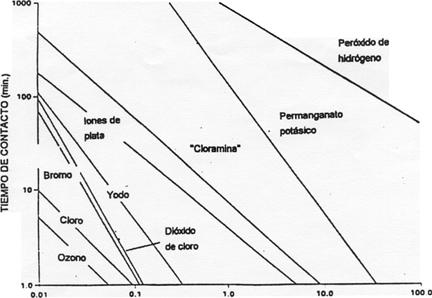
CONCENTRACION DE DESINFECTANTE
(mg./l.)
Fig.-2. Eficacia relativa de los diferentes desinfectantes
químicos ante Coolí a un pH. de 7.5 y una temperatura de 5 ºC
Demanda de cloro y break point
La cantidad de cloro que debe utilizarse para la
desinfección del agua, se determina generalmente mediante el método de la
demanda de cloro y el de breakpoint.
Al incorporar el cloro al agua,
reacciona con las sustancias que ésta contiene, quedando menos cloro en
disposición de actuar como desinfectante. Entre estas sustancias destacan el
manganeso, hierro, nitritos, sulfhídrico y diferentes materias orgánicas,
las cuales, además de consumir cloro, producen compuestos orgánicos clorados
que pueden ser la causa de olores y sabores desagradables. Otra sustancia
presente, a veces ,en el agua y que reacciona de una forma muy particular
con el cloro es el amoníaco. En este caso se forman compuestos denominados
cloraminas, las cuales poseen poder desinfectante, aunque en menor grado que
el cloro.
Si se continúa añadiendo cloro en
exceso, de manera que reaccione con todas las sustancias presentes, llegará
un momento en que el cloro sobrante aparecerá como cloro residual libre, que
es el que realmente actúa ahora como agente desinfectante.
La demanda de cloro es
la diferencia entre la dosis de cloro añadida y el contenido de cloro
residual al cabo de un tiempo de contacto suficiente para completar las
reacciones antes expuestas.
El control perfecto de
la desinfección, se efectúa mediante los correspondientes exámenes
bacteriológicos del agua, pero para un control más rápido del contenido en
cloro libre y combinado de un agua tratada, se determina la concentración de
cloro residual mediante el método del DPD, o bien por yodometría y
valoración con tiosulfato sódico; también, en instalaciones importantes
suelen emplearse instrumentos automáticos de medida permanente, mediante
determinaciones colorimétricas o determinaciones amperométricas.
El cloro presente en el
agua tratada que se conoce como «cloro residual», puede presentarse como
«cloro residual libre» o como «cloro residual combinado».
El cloro residual
libre está constituido esencialmente por el ácido hipocloroso y el ión
hipoclorito; y el cloro residual combinado lo forman generalmente las
cloraminas.
Para que el cloro
residual libre esté presente en un agua tratada con cloro después del
suficiente tiempo de contacto, es necesario que la cloración se lleve a cabo
mediante una dosis lo suficientemente elevada de cloro, hecho conocido como
«dosificación con cloro sobrante», «cloración por el punto crítico» o
«cloración al breakpoint», con lo cual el cloro oxidará todas las sustancias
que estén en disposición de ser oxidadas, se combinará, destruirá y
eliminará otras, como por ejemplo las cloraminas , y después de todo esto
aún quedará un exceso de cloro libre residual. La dosis de cloro a la cual
comienza a aparecer el cloro libre residual es la llamada dosis de
breakpoint. Indicaremos ahora, y después ampliaremos, que algunas de las
sustancias orgánicas cloradas
formadas con el cloro libre son causa de preocupación desde el punto
de vista sanitario.
Teóricamente, en un agua totalmente pura, al ir adicionando cloro, la
concentración residual medida del mismo sería igual al cloro incorporado.
Pero esto no ocurre así en aguas que no son completamente puras, que es el
caso general. Entonces, al ir adicionando cloro y después de haberse oxidado
las diversas sustancias que ya indicamos y formado las cloraminas, si había
presente amoníaco y otros compuestos clorados de adición, si medimos ahora
el cloro residual, se observará que éste no corresponde al añadido, sino que
es menor, llegando incluso a un punto, en que en lugar de ir aumentando la
concentración de cloro residual ésta disminuye. La explicación de este
descenso se justifica por el hecho de que una vez formados los diversos
derivados orgánicos del cloro y las cloraminas, llegan a destruirse mediante
la adición de más cloro, formándose otros compuestos que no suministran
cloro residual. Cuando se han destruido estos compuestos clorados, comienza
a aparecer el cloro residual libre, ya medida que se añade cloro al agua
aumenta la concentración de cloro residual libre, pudiendo subsistir a la
vez una pequeña concentración de cloro residual combinado, debido a
compuestos que no han sido destruidos totalmente. Se considera que cuando el
85 % ó más del cloro residual del agua está en forma libre, la desinfección
se ha realizado al breakpoint.
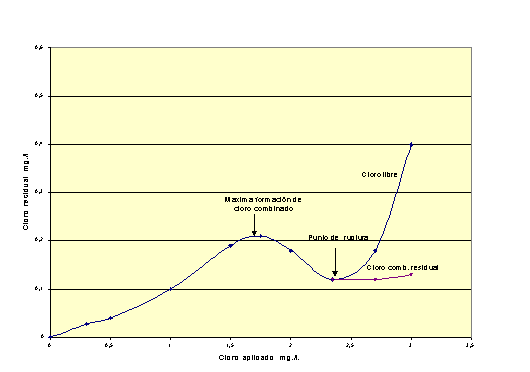
Fig. 3
En la figura 3 queda
mostrado de forma gráfica lo anteriormente expuesto. El breakpoint es la
dosis correspondiente al mínimo de la curva. Este punto no lo presentan
claramente las aguas con poca materia orgánica o compuestos nitrogenados.
Cuando se realiza una
cloración al breakpoint, no sólo es el CIOH que persiste al terminar las
reacciones ( cloro residual libre) el que se utiliza para la desinfección,
sino que también se está utilizando, en parte, para la desinfección, el CIOH
que existe durante el desarrollo y consecución del breakpoint. Esta
disponibilidad temporal de CIOH es función del pH, temperatura y
concentración de cloro y amoníaco.
Demanda de cloro
La cantidad de cloro que debe utilizarse para la
desinfección del agua, se determina generalmente mediante el método de la
demanda de cloro y el de breakpoint.
Al incorporar el cloro al agua,
reacciona con las sustancias que ésta contiene, quedando menos cloro en
disposición de actuar como desinfectante. Entre estas sustancias destacan el
manganeso, hierro, nitritos, sulfhídrico y diferentes materias orgánicas,
las cuales, además de consumir cloro, producen compuestos orgánicos clorados
que pueden ser la causa de olores y sabores desagradables. Otra sustancia
presente, a veces ,en el agua y que reacciona de una forma muy particular
con el cloro es el amoníaco. En este caso se forman compuestos denominados
cloraminas, las cuales poseen poder desinfectante, aunque en menor grado que
el cloro.
Si se continúa añadiendo cloro en
exceso, de manera que reaccione con todas las sustancias presentes, llegará
un momento en que el cloro sobrante aparecerá como cloro residual libre, que
es el que realmente actúa ahora como agente desinfectante.
La demanda de cloro es
la diferencia entre la dosis de cloro añadida y el contenido de cloro
residual al cabo de un tiempo de contacto suficiente para completar las
reacciones antes expuestas.
El control perfecto de
la desinfección, se efectúa mediante los correspondientes exámenes
bacteriológicos del agua, pero para un control más rápido del contenido en
cloro libre y combinado de un agua tratada, se determina la concentración de
cloro residual mediante el método del DPD, o bien por yodometría y
valoración con tiosulfato sódico; también, en instalaciones importantes
suelen emplearse instrumentos automáticos de medida permanente, mediante
determinaciones colorimétricas o determinaciones amperométricas.
El cloro presente en el
agua tratada que se conoce como «cloro residual», puede presentarse como
«cloro residual libre» o como «cloro residual combinado».
El cloro residual
libre está constituido esencialmente por el ácido hipocloroso y el ión
hipoclorito; y el cloro residual combinado lo forman generalmente las
cloraminas.
Para que el cloro
residual libre esté presente en un agua tratada con cloro después del
suficiente tiempo de contacto, es necesario que la cloración se lleve a cabo
mediante una dosis lo suficientemente elevada de cloro, hecho conocido como
«dosificación con cloro sobrante», «cloración por el punto crítico» o
«cloración al breakpoint», con lo cual el cloro oxidará todas las sustancias
que estén en disposición de ser oxidadas, se combinará, destruirá y
eliminará otras, como por ejemplo las cloraminas , y después de todo esto
aún quedará un exceso de cloro libre residual. La dosis de cloro a la cual
comienza a aparecer el cloro libre residual es la llamada dosis de
breakpoint. Indicaremos ahora, y después ampliaremos, que algunas de las
sustancias orgánicas cloradas formadas con el cloro libre son causa de
preocupación desde el punto de vista sanitario.
Cloro
residual en la red de distribución
El consumo de cloro en el agua de
una red de distribución se debe, por una parte, al consumo del cloro por la
propia agua (sustancias presentes en ella y otras condiciones físicas) y por
otra, al consumo que se produce en la interfase con las paredes de las
conducciones.
En el agua, el
consumo depende principalmente de la temperatura y del contenido en materias
orgánicas disueltas (COT).
En la interfase con
las paredes, el consumo de cloro se produce por la interacción con los
productos de corrosión y por los depósitos y biomasa fijada en las paredes.
La disminución del
cloro residual en una masa de agua, viene expresada por la ecuación
exponencial siguiente:
C(t) = C0.e-kt
C(t) = Concentración
de cloro (mg/l.) en el tiempo t.
C0 =
Concentración inicial de cloro (mg/l.)
t = Tiempo de
reacción.
Es decir, hay una disminución
exponencial de cloro residual con el tiempo.
La constante K puede ser calculad
por la siguiente ecuación:
K =
ln (C0/Ct)
T
Un tiempo de
exposición mínimo es necesario para que la concentración de cloro aplicado
garantice la desinfección.
En 1908, los
investigadores Chick y Watson desarrollaron lo se llamó la ley de Chick .
Este principio describe el tiempo y la concentración de desinfectante que se
necesita para matar los microbios en el agua
, determinaron que al aumentar el tiempo de
duración del contacto del desinfectante en el agua, disminuye el número de
microbios en esta comprobandose que este producto es importante en la
destrucción de microbios potencialmente nocivos.
Para un agua
correctamente pretratada, se debe mantener un C.t del orden de 15 (mg.min/.l),
por ejemplo 0,5 mg/l. de cloro libre durante 30 minutos, ó 0,25 mg/l.
durante 1 hora.
A título de ejemplo
comparativo, se muestran valores C.t para diversos desinfectantes:
Cloro =
15 (0,25 mg/l. durante 60 minutos)
Ozono =
1,6 (0,40 mg/l. durante 4 minutos)
ClO2 =
10 (0,30 mg/l. durante 33 minutos)
Monocloramina
= 100 (0,80 mg/l. durante 120 minutos)
La United States Environmental
Protection Agency (USEPA) ha publicado tablas con valores de CT para
inactivación de Giardia a diferentes temperaturas y pH. Así por ejemplo a la
temperatura de 25ºC y pH 8,0, con un cloro residual en el rango de 1 a 2,6
mg/l, es necesario un tiempo de contacto de 54 – 65 minutos para conseguir
una reducción en Giardia del 99,9 % ( 3-log.) Cuando la temperatura se
reduce a 10 ºC el tiempo de contacto de eleva a 162 -194 minutos y para una
temperatura de 5 ºC el tiempo de se incrementa a 304 – 368 minutos. En las
tres siguientes tablas se muestran estos resultados.
EL FACTOR CT : Exposición
Valores estimados de CT para la
inactivación de quistes de Giardia con cloro libre a 25 ºC
pH 7 pH8
Log
inactivación Log inactivación
____________________ ___________________
Cloro (mg/l)
1 2 3 1
2 3
==========================================================
1
12 25 37
18 36 54
1,6
13 27 40
19 39 58
2
14 27 41
20 41 61
Fuente: EPA, 1990
Valores estimados de
CT para la inactivación de quistes de Giardia con cloro libre a 10 ºC
_____________________________________________________________
pH
7 pH 8
Log inactivación
Log inactivación
__________________
________________
Cloro (mg/l)
1 2 3 1 2 3
_____________________________________________________________
1
37 75 112 54 108 162
1,6
40 79 119 58 116 174
2
41 83 124 61 121 182
2,6
44 87 131 65 129 194
_____________________________________________________________
Fuente:
EPA, 1990
Valores estimados de
CT para la inactivación de quistes de Giardia con cloro libre a 5 ºC
______________________________________________________________________
pH
7 pH 8
Log inactivación Log inactivación
___________________
___________________
1
70 140 210
101 203 304
1,6
75 151 226
110 219 329
2
79 157 236
115 231 346
2,6
84 168 252
123 245 368
_______________________________________________________________
A efectos comparativos de diversos desinfectantes, se representa a
continuación los valores CxT para el cloro, cloraminas, dioxido de cloro
y ozono en la inactivación de virus
Valores
de
C*T
para
inactivación de
virus
con
cloro
libre
(mg/l*
min).
(Fuente:
EPA, «Disinfection Profiling and Benchmarking Guidance
Manual», Agosto 1999)
|
Temperatura
(°C) |
Log de inactivación |
|
2,0
– log |
3,0
– log |
4,0
-
log |
|
pH
6-9 |
PH
10 |
PH
6-9 |
pH
10 |
pH
6-9 |
pH
10 |
|
0,5 |
6 |
45 |
9 |
66 |
12 |
90 |
|
5 |
4 |
30 |
6 |
44 |
8 |
60 |
|
10 |
3 |
22 |
4 |
33 |
6 |
45 |
|
15 |
2 |
15 |
3 |
22 |
4 |
30 |
|
20 |
1 |
11 |
2 |
16 |
3 |
22 |
|
25 |
1 |
7 |
1 |
11 |
2 |
15 |
Valores
de
C*T
(mg/l*min),
para inactivación
de Virus
con cloraminas,
pH
6-9
(Fuente: AWWA,
1991 en
Alternative Disinfectants and Oxidants
Guidance Manual,
Abril 1999)
|
|
Temperatura
(°C) |
|
Inactivation |
5 |
10 |
15 |
20 |
25 |
|
2-log |
857 |
643 |
428 |
321 |
214 |
|
3-log |
1.423 |
1.067 |
712 |
534 |
356 |
|
4-log |
1.988 |
1.491 |
994 |
746 |
497 |
Valores de
C*T
para inactivación de Virus
con Dióxido
de Cloro,
pH 6-9
(Fuente:
Disinfection Profiling and
Benchmarking Guidance Manual,
EPA 815-R-99-
013, Agosto
1999)
|
INACTIVACIÓN
(LOG) |
T E M P
E R
A T
U R
A (ºC) |
|
1 |
5 |
10 |
15 |
20 |
25 |
|
2 |
8,4 |
5,6 |
4,2 |
2,8 |
2,1 |
1,4 |
|
3 |
25,6 |
17,1 |
12,8 |
8,6 |
6,4 |
4,3 |
|
4 |
50,1 |
33,4 |
25,1 |
16,7 |
12,5 |
8,4 |
Valores
de
C*T
para
inactivación de
Virus
con
Ozono
(Fuente:
Disinfection
Profiling
and Benchmarking
Guidance Manual,
EPA 815-R-99-013, Agosto 1999)
|
INACTIVACIÓN
(LOG) |
T E M P
E R
A T
U R
A (ºC) |
|
1 |
5 |
10 |
15 |
20 |
25 |
|
2 |
0,90 |
0,60 |
0,50 |
0,30 |
0,25 |
0,15 |
|
3 |
1,40 |
0,90 |
0,80 |
0,50 |
0,40 |
0,25 |
|
4 |
1,80 |
1,20 |
1,00 |
0,60 |
0,50 |
0,30 |
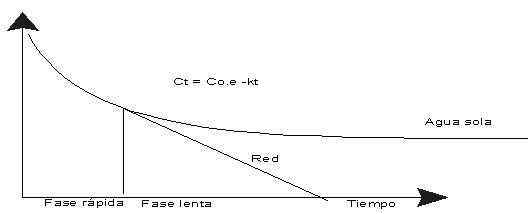
En la figura anterior se
representa un esquema de la cinética de la disminución del cloro en el agua
de una vasija inerte y en una canalización (red):
Las dos técnicas de cloración generalmente
empleadas son la cloración residual libre y la cloración residual combinada
(más la primera que la segunda).
La técnica de la cloración residual libre
supone la aplicación de cloro al agua para conseguir que ya sea directamente
o bien después de la destrucción del amoníaco, quede un cloro residual
libre, tanto a la salida de la planta como en la red de abastecimiento.
La técnica de la cloración residual combinada
implica la reacción del cloro con el amoníaco natural o añadido (sin llegar
a la destrucción de éste) y mantener este cloro residual combinado en la
red.
Empleando cloro como oxidante/desinfectante
primario, se ha comentado que la formación de THMs y otros subproductos se
ve favorecido con el aumento de la dosis de cloro y con el aumento del
tiempo de contacto agua-cloro. Por otra parte, se sabe que para una efectiva
desinfección (cloración) hay que mantener una adecuada concentración de
cloro libre residual durante un determinado tiempo de contacto. El producto
de la concentración de cloro libre en mg/l. y el tiempo de contacto en
minutos, es decir C.t. es un indicador del potencial de desinfección en el
proceso de cloración.
Está comprobado que los contenidos de THM a la
salida de las estaciones de tratamiento se incrementan posteriormente en
muchos casos, ya en la red, debido principalmente al mayor tiempo de
contacto del cloro con la materia orgánica que sale de la estación y con las
sustancias orgánicas que forman el biofilm de la red.
La desinfección debe realizarse en la estación de
tratamiento y no contar con el tiempo que el agua ha de estar en la red para
que se garantice el producto C.t. de forma que el primer consumidor de agua
de la red beba un agua perfectamente desinfectada.
Se presenta entonces el dilema de si mantener o no una
determinada concentración de cloro residual para prevenir posibles
recontaminaciones, recrecimiento del biofilm y otros objetivos que
posteriormente se indicaran. La necesidad de mantener un residual, está
también siendo cuestionada; ya dijimos al principio que sólo en España y
Portugal dentro de la UE requieren legalmente mantener un desinfectante
residual en el sistema de abastecimiento. Esta necesidad depende en gran
medida de las condiciones locales y circunstanciales climáticas y
geográficas en general, y en cuanto a la cantidad o concentración a
mantener, depende mucho de la tradición y aceptación de los consumidores.
Si se opta por mantener un desinfectante residual en la
red, cloro libre, habría que volver a reclorar el agua y mantenerla así
durante el largo período de estancia de los grandes y extensos sistemas de
distribución, es decir, aumentando dos de los factores (C y t) que potencian
la formación de THMs. La incapacidad del cloro para mantener una
concentración residual consistente y estable en los sistemas de distribución
extensos, le limita como un adecuado desinfectante secundario.
¿Sería conveniente entonces buscar una alternativa al cloro libre que
además de no formar estos subproductos sea más estable y por tanto su
concentración se mantenga casi constante desde que el agua sale de la
estación de tratamiento hasta que llega al consumidor más alejado?. Aparece
entonces la solución del cloro residual combinado, en forma de cloraminas,
como una eficaz alternativa.
La desinfección del agua potable no conduce a una
completa esterilización, es decir a una completa eliminación de patógenos y
no patógenos, por tanto y aceptando la presencia de nutrientes, son posibles
los recrecimientos de bacterias y otros microorganismos. Aunque el proceso
de tratamiento aplicado al agua sea correcto, algunos organismos pueden
sobrevivir a este tratamiento y pasar al sistema de distribución junto a
pequeñas fracciones de sustancias orgánicas que inducen a la formación del
biofilm. Este biofilm a su vez puede proporcionar una cierta protección a
los microorganismos patógenos, protección que será difucultada si se emplea
cloro residual en la red.
Pueden aducirse varias razones en favor del
mantenimiento de un desinfectante residual en el sistema de distribución:
1) Controlar y minimizar el recrecimiento del biofilm.
2) Reducir el riesgo de una contaminación por intrusión
desde el exterior al interior del sistema de distribución
3) El uso de cloro residual y su control continuo,
servirá como indicador de roturas de un sistema de distribución y puede ser
usado para detectar intrusiones más rápidamente que una monitorización
microbiológica y además su análisis continuo abarca o afecta a prácticamente
todo el volumen de agua del sistema.
4) Estabilizar la calidad del agua en el sistema, no
sólo en cuanto a controlar la formación de biofilm y recrecimiento
bacterianos, sino también reducir los fenómenos de corrosión de la red, la
corrosión es un factor importante en la reducción del cloro residual.
Elección del desinfectante residual
Aceptando el mantenimiento de un desinfectante
residual, se debe minimizar este residual y los subproductos formados para
lo cual es necesario y fundamental:
1) Tratar el agua para reducir la materia orgánica
natural (MON) que sirve como precursor de los subproductos de la
desinfección.
2) Tratar el agua para mejorar la estabilidad del
desinfectante residual, ya que cuanto más estabilidad del residual, menor
desinfectante será necesario.
3) Hacer una cuidadosa elección del
oxidante/desinfectante, siguiendo los criterios de máxima estabilidad, máximo
control del biofilm, mínima toxicidad directa y mínima formación de
subproductos.
En el siguiente cuadro se comparan las tres principales alternativas para el
mantenimiento de un residual desde las perspectivas o criterios antes
señalados; 1) Estabilidad del residual, 2) Toxicidad del residual (según
límites de la USEPA), 3) Control del Biofilm y 4) Formación de
subproductos.
|
Oxidante |
Estabilidad residual |
Límite del residual mg/l (USEPA)
|
Control biofilm |
Subproductos |
|
Cloro libre
Dióxido de cloro
Cloraminas |
Muy buena
Buena
Excelente |
4
0,8
4 |
Buena
Buena
Muy buena |
Mala
Buena
Muy buena |
De las tres substancias indicadas, el cloro libre es el
más utilizado pero su mal comportamiento en cuanto a la formación de
subproductos limitará su empleo en el futuro a aguas con muy pocos
precursores.
Las cloraminas y concretamente la monocloramina es una
importante alternativa, siendo su principal desventaja el hecho de estar
sujeta a una nitrificación en el sistema de distribución, por diferentes
factores como alta temperatura, puntos muertos o retenciones excesivas donde
el residual desaparece y el biofilm se elimina con dificultad, y exceso de
amoníaco. Hay que tener presente que las cloraminas no suelen emplearse en
la desinfección primaria. Son más empleadas en Estados Unidos que en Europa,
donde se emplea más el dióxido de cloro que por su parte presenta problemas
debidos a su propia toxicidad y a la formación de clorito y clorato que se
producen como substancias oxidadas.
Aunque puede concluirse que no hay un desinfectante
perfecto, el más adecuado y la cantidad a aplicar dependerá de las
condiciones y circunstancias locales que al fin nos lleve a disponer de un
agua con el más bajo olor y sabor al desinfectante y subproductos derivados
de él, a la vez que se consiga la mayor efectividad de desinfección
Dado el menor poder oxidante
y de desinfección del cloro residual combinado, se suele emplear éste para
una desinfección secundaria, después de aplicar la técnica de la cloración
libre dentro del proceso de tratamiento hasta la etapa de filtración y a
continuación, tras la filtración, se aplica amoníaco y más cloro, si es
necesario, para lograr la concentración de cloro combinado (cloramina)
deseada, es decir, que después de destruir las cloraminas que pudieran
haberse formado con el amoníaco o substancias orgánicas nitrogenadas
presentes en el agua bruta y satisfacer la demanda de cloro
de este agua, quede aún cloro libre residual (cloración
con cloro sobrante) que será transformado en cloro combinado al incorporar
amoníaco.
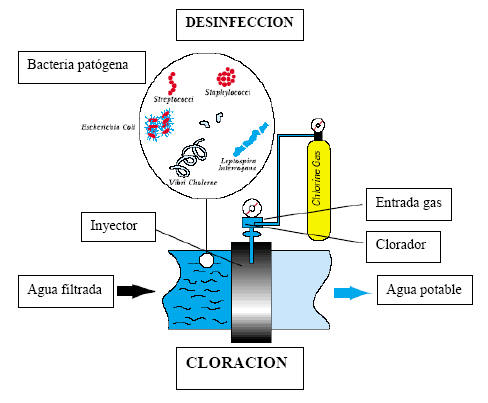
Equipos e
instalaciones de cloración
Tanto para la dosificación del cloro, como para la del
amoníaco, se emplean equipos similares, aunque, naturalmente, y dado el
diferente comportamiento químico de estas dos sustancias, se introducen
algunas diferencias, principalmente en cuanto a la naturaleza de los
materiales de la instalación.
El cloro que se emplea en las instalaciones de cloración,
en estaciones de tratamiento, suele suministrarlo la industria en botellones
de 50 kgs. y tanques o bidones de 1.000 kgs., en los cuales el cloro está a
presión en fase líquida en equilibrio con la parte gaseosa. Estos bidones
tienen dos tomas: la parte superior, por la que se puede extraer el cloro
gas directamente (las posibilidades de vaporización de un contenedor son del
orden de 1,5 % y por hora de su contenido), y la parte inferior, por la que
se extraerá el cloro líquido cuando el consumo es más elevado, requiriendo
en este caso la instalación el empleo de evaporadores que, en realidad, son
unas cubas de acero en cuyo interior se encuentran en equilibrio el cloro
líquido y el cloro gas y por el exterior están rodeadas por una cuba de agua
calentada por resistencias eléctricas con los correspondientes mecanismos de
regulación.
El cloro gas que sale del evaporador pasa a un filtro
para que queden retenidas las pequeñas impurezas que puedan acompañar al
cloro y no lleguen a la válvula reguladora ni a los cloradores. Esta válvula
se encarga de reducir adecuadamente la presión del gas a la salida del
evaporador, para conseguir que el cloro se mantenga en forma gaseosa en el
resto de la instalación e impedir una relicuación del cloro y que llegue en
estado líquido al clorador, lo que provocaría su destrucción.

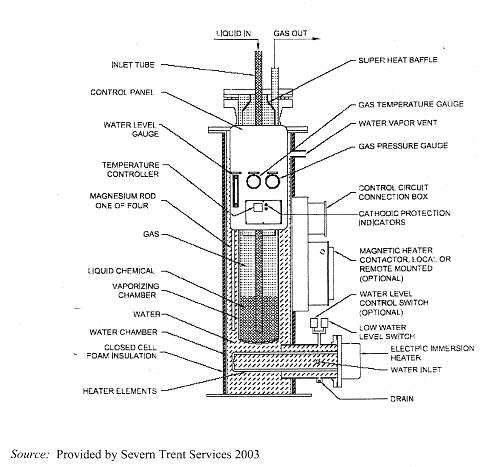
Instalación de evaporación de cloro
Detalle de evaporador
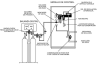
Esquema de extracción de cloro gas
Esquema de extracción de cloro liquido
Los
cloradores o clorómetros, a donde llega el cloro gas que sale de los
evaporadores (o directamente procedente de los contenedores en el caso de
pequeñas instalaciones, que no requieren evaporador), regulan la cantidad de
cloro a dosificar .El principio de funcionamiento de los cloradores se basa
en la transmisión del vacío creado por la circulación de agua a través de un
inyector a una válvula diferencial, que mantiene una presión diferencíal
constante en un regulador de caudal, con válvula de orificio de sección
variable, para regular el caudal. Por su parte, el cloro a presión llega a
una válvula reguladora de presión, hasta quedar a una presión inferior a la
atmosférica, y de aquí a un rotámetro para medir el caudal. El cloro pasa a
la válvula de presión diferencial ya continuación al inyector, donde se
mezcla con una corriente de agua auxiliar, obteniéndose un agua fuertemente
concentrada (entre 1 y 3 gr/l) que es la que se envía al agua objeto de la
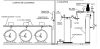
cloración. El clorador descrito, completado con los correspondientes
manómetros y válvulas de seguridad y drenaje, así como el esquema completo
de una instalación de cloración clásica ,se representan en las figuras 4 y
5.



Fig.
4 Esquema funcional de un clorador
Fig. 5. Esquema de instalaciones de cloración
Un
clorador más simple para instalar generalmente sobre el propio contenedor de
cloro, que en este caso suele ser en la parte superior de una botella, lo
constituye un regulador similar al descrito y que consta fundamentalmente de
una válvula de entrada de cloro gas, una cámara con una membrana o
diafragma, que es desplazada por el vacío al que se la somete, de forma que
actúa sobre un muelle y eje con obturador, para abrir o cerrar el paso del
gas y un tubo rotámetro para medir el caudal de gas mediante la
adecuada válvula de regulación. En los esquemas de la figura 6, se observan
estos cloradores. Cuando el
conjunto regulador se somete al vacío creado por el eyector, el diafragma se
moverá (hacia la izquierda en el esquema), comprimiendo el muelle y
desplazando a su vez el eje obturador de la válvula de entrada, de forma que abre el
paso de gas hacia el clorador. Si se interrumpe el vacío, la válvula de
entrada se volverá a cerrar por la acción del muelle.
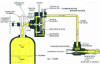

Fig. 6.- Esquema clorador sobre botella
En estos
sistemas de cloración, con los cloradores descritos, mediante vacío,
aseguran que si ocurre alguna rotura en la línea de cloro gas sometida a
vacío (por ejemplo el tubo rotámetro de cristal),se cerraría la válvula de
entrada de gas, al anularse el vacío, evitando la salida de cloro al
exterior.


Cabinas para dosificación de cloro y dióxido de cloro

Absorción y
neutralización del cloro en caso de fugas
Es
sobradamente conocido que el cloro es un fuerte irritante de las vías
respiratorias y que puede llegar a producir graves intoxicaciones e incluso
la muerte en caso de inhalación de importantes concentraciones, la gravedad
dependerá del tiempo de exposición y de la concentración en el aire que
respiramos. En el siguiente cuadro se indican la reacciones fisiológicas de
las personas ante estas situaciones.
|
EFECTOS |
ppm
(ml Cl2 / m3 de aire) |
mg. Cl2 / m3
aire |
|
Mínima cantidad para
producir síntomas leves tras varias horas de exposición |
1 |
3 |
|
Mínimo olor perceptible,
ligera irritación ocular |
3 |
9
|
|
Irritación en garganta |
15 |
45 |
|
Mínima cantidad que produce tos persistente |
30
|
90 |
|
Peligro grave, aún a corta
exposición |
40-60 |
120-180 |
|
Fatal después de 30 minutos
de exposición |
400 |
1200 |
|
Rapidamente fatal en unas pocas inhalaciones
(muerte en pocos segundos) |
1000 |
3000 |
Las fugas
o escapes de cloro pueden ser de poca entidad o fugas menores y fugas
de gran importancia o fugas mayores, que generalmente están con el
cloro liquido. Las fugas menores suelen deberse a fallos en los ajustes de
válvulas, juntas, o en los propios equipos de dosificación. Las fugas
mayores suelen ocurrir principalmente por rotura en los contenedores o sus
válvulas, roturas de conducciones y conexiones flexibles y en general
roturas en conducciones y equipos donde el cloro está a presión y en estado
liquido.
Para
evitar o disminuir los riesgos de fuga cloro en la linea de cloro y
concretamente en las válvulas de los contenedoreso ideal es instalar
sistemas de cierre automatizados mediante válvulas de cierre automáticas
colocadas a la salida del contenedor, controladas y automatizadas por medio
de microprocesadores comandados por un sistema de detección de gas que
responde de inmediato ante una fuga de gas.
(Sistemas
de cierre de la empresa Halogen Valve Systems)

Cálculo de una fuga de cloro.
A este
respecto se han realizado estudios y pruebas para evaluar el caudal o tasa
en la fuga de cloro que se origina como consecuencia de una rotura en una
instalación de cloración ,así por ejemplo, el Chlorine Institute ha dado
unas "fórmulas sobre el caudal de escape", para el caso de fugas de cloro
liquido o cloro gaseoso.
Para el
caso de cloro de liquido:
Q = 77A √(P1 -P2 ) . r
(libras/seg.)
donde :
A =
Superficie de la apertura o rotura abierta a la atmósfera en pies cuadrados
(ft2)
P1= Presión en la zona anterior a la
rotura en psi
P2= Presión en la zona posterior a la
rotura en psi
r = Densidad del cloro liquido, anterior a
la rotura abierta a la atmósfera en lb/ft3
La
anterior ecuación, expresada en otras unidades, quedaría de forma aproximada
en :
Q = 0,0096 A√(P1 - P2 ). r (
Kg./seg.)
donde ahora :
A = (cm2 )
P1 y P2 = (psi)
r = ( Kg./m3 )
Para el
caso de una fuga de cloro gas:
Q = 36,6 A √ P/V (libras/seg.)
En esta
ecuación, V = Volumen específico del cloro gas, anterior a la rotura abierta
a la atmósfera (1/r), en ft3/lb ).
Si se
expresa Q en Kg./seg. , A en cm2 , y V= 1/r , en m3/Kg. , la
anterior ecuación quedaría así :
Q = 0,00447 A √ P / V = 0,00447 A √ P. r ( Kg./ seg.)
Ejemplos :
A)
Supuesto de escape de cloro liquido a través de un orificio de 0,5 cm. de
diámetro, en la línea de cloro liquido, incluido el propio contenedor. La
presión de en el interior del contenedor (función de la temperatura), se
puede fijar en 8 Kg./cm2 , aproximadamente 110 psi y cae a cero
en el punto de fuga. La densidad del cloro en el interior del contenedor
puede considerarse del orden de 1300 Kg./m3 .
Aplicando
la primera formula:
Q = 0,0096 π d2 /4 √ (110-0) . 1300 = 0,0096 x 3.14x0,52
/ 4 x 378,1 = 0,712 Kg./seg. = 42,7 Kg. /minuto
Esta
situación es la peor de todos los casos, al no haber considerado en la
rotura las restricciones al paso del cloro liquido por las distintas
válvulas, conectores flexibles, etc.
B)
Supuesto de escape de cloro en fase gaseosa. Este caso pone de manifiesto la
diferencia en el caudal de fuga, cuando esta tiene lugar en un punto donde
el cloro está en forma gaseosa y por tanto la conveniencia de colocar el
contenedor, en caso de fuga, de forma que esta se sitúe en la zona del gas,
en este caso el escape de cloro enfriará el liquido en 3 o 4 minutos, la
presión del contenedor disminuirá, llegando tan baja como 2 a 3 kg./ cm2
. La densidad del cloro gas a la presión atmosférica es 3,2 kg./m3
.
Aplicando
la 2ª formula, el caudal de escape será:
Q = 0,0047 π d2 /4 √ (40-0) . 3,2 = 0,0047 x 3,14 x 0,52
/ 4 x 11,3 = 0,010 Kg./seg. = 0,600 Kg. /minuto
Como
ejemplo algo más ilustrativo vamos a exponer el volumen de aire y la
concentración en cloro de esta masa de aire que se ve afectada por una
determinada fuga de cloro. Teniendo en cuenta el anterior cuadro y
considerando que aproximadamente una concentración de 100 mg. de cloro por m3
de aire, es ya una concentración que hace inhabitable ese lugar, podemos
calcular el caso de una fuga de cloro de 1 kg., admitiendo que se ha
difundido de forma homogénea en todas direcciones. Para alcanzar la
concentración mencionada (100 mg/m3), el volumen ocupado sería
10.000 m3 . Si ahora suponemos que este volumen ocupara la forma
geométrica de una semiesfera sobre el suelo alrededor del punto de fuga, la
superficie sobre el suelo sería de unos 900 m2 , con un radio de
17metros.
Si
suponemos que la fuga es de 100 Kg. de cloro, el volumen ocupado (para
llegar a la concentración de 100 mg/m3 ) sería 1.000.000 m3
y la superficie sobre el suelo, unos 19.000 m2 con un radio de 78
m.
Si la
fuga de cloro es la de un tanque de 1.000 Kg., el volumen afectado sería
10.000.000 m3, con una superficie afectada de unos 89.000 m2
y un radio de 168 m.
En
realidad las superficies afectadas son mayores que las indicadas, ya que al
ser el cloro gas más denso que el aire, la semiesfera perfecta que hemos
supuesto, sería más aplastada, ocupando más superficie; también hay que
tener en cuenta que hemos supuesto una difusión uniforme, lo cual no es muy
probable debido a las corrientes de aire. Estos datos nos dan idea de la
gravedad de estas situaciones. Por otra lado, como factor que compensa, en
parte, la gravedad de la exposición anterior , hay que señalar que el tiempo
necesario para la difusión uniforme y homogénea del cloro en el aire, si no
hay viento, es relativamente lenta. La difusión de 1 Kg. de cloro ,de forma
homogénea, en 10.000 m3 de aire puede ocupar varias horas.
El
tamaño y tiempo de exposición de un área afectada dependerá de:
-Cantidad de cloro liberado a la atmósfera
-Tasa de la fuga de cloro
-Altura del punto donde ocurrió el escape
-Estado físico del cloro liberado
-Líquido ó Gaseoso
-Condiciones ambientales
-La concentración de cloro en el ambiente puede variar desde baja a
alta concentraciones
Las fugas de cloro en las Estaciones de Tratamiento de Agua
son un hecho potencial que obliga a adoptar medidas que neutralicen estas
posibles fugas. En instalaciones de cierta importancia y en el caso de
locales cerrados lo habitual es disponer de un equipo o instalación de
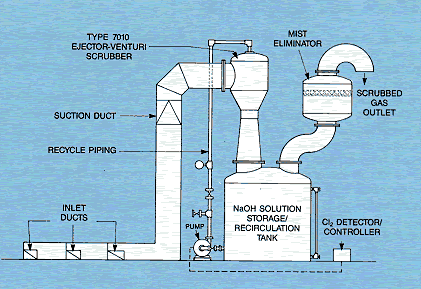
absorción y neutralización de estas fugas, conocida generalmente como “torre
de absorción”, en realidad es un sistema de Scrubber diseñado para vehicular
hacia él todo el aire contaminado del lugar donde se produce la fuga.
Usualmente se diseña para proporcionar una completa renovación del aire del
local cada 6 o 7 minutos. En el diseño de las instalaciones de absorción se
deben tener en cuenta diversos factores, tales como el caudal del ventilador-extractor
y la cantidad y concentración de la solución absorbente o neutralizante.
Sobre las instalaciones de absorción de fugas de cloro, se
recogen diversas disposiciones en la Normativa de la ITC MIE, APQ-003
“Almacenamiento de cloro”. A continuación se transcriben los Art. 19 y 20
del Capítulo V, sobre “Instalaciones de absorción de cloro”.
Art. 19: La cantidad de agente neutralizante (hidróxido sódico,
sulfito sódico, entre otros), disponible en la instalación debe ser
suficiente para tratar todo el volumen del cloro contenido en el recipiente
de mayor capacidad existente en el almacenamiento.
Art. 20: Cuando se trata de almacenamiento en el interior de un
edificio cerrado, se asegurarán, cuando menos, diez renovaciones por hora
del aire interior. La instalación de absorción en este supuesto, será capaz
de tratar todo el caudal de gases, admitiendo un contenido en cloro del 10
%.
El aire cargado de cloro es aspirado por un extractor que lo
impulsa hacia la parte inferior (de abajo hacia arriba) de la torre de
absorción, rellena de anillos Raschig, para aumentar la superficie de
contacto, y a contracorriente se hace pasar una lluvia de una solución
absorbente generalmente hidróxido sódico. Sería aconsejable que el aire
exento de cloro que sale por la parte superior de la torre pudiera
recircular en circuito cerrado, durante los primeros ciclos, hacia el mismo
local, y posteriormente cuando la concentración de cloro en la sala de fuga
ha decrecido, podría ya evacuarse el aire totalmente exento, que sale de la
torre, hacia la atmósfera.
La concentración de la solución de NaOH suele ser del 27% o
menor, dependiente del riesgo de cristalización en épocas de bajas
temperaturas.
La reacción del cloro con la sosa, en la torre de absorción
produce hipoclorito sódico, que puede ser enviado a un depósito de
neutralización con hiposulfito sódico en solución al 5%.
La reacción química en la absorción viene dado por:
2NaOH + Cl2 + xH2O = 2ClONa + (x+1)H2O
Teniendo en cuenta la dilución de la sosa y que al final de la
operación debe haber un exceso de ésta del orden del 3%, la ecuación de la
reacción será:
2,3NaOH + Cl2 + 14H2O
=
ClONa + ClNa + 15H2O
+ 0,3NaOH

415 415
Según la anterior ecuación 1 kg de cloro necesitaría 1,3
kg de NaOH o 4,8 kg de solución al 27%.
La reacción es exotérmica (352 Kcal/kg de Cl2)
y elevará la temperatura en la zona de reacción de la torre (anillos Raschig).
El hipoclorito formado puede neutralizarse con una
solución al 5% de hiposulfito sódico (la reacción es muy exotérmica y debe,
por tanto, manejarse soluciones muy diluidas).
2S2O3Na2 +
ClONa + xH2O = S4O6Na2 + 2Na(OH)
+ (x-1)H2O
La reacción de neutralización, teniendo en cuenta el
grado de dilución de hiposulfito, viene dada por:
2S2O3Na2 + ClONa + ClNa + (334+15)H2O
+ 0,3NaOH =
S4O6Na2 +
2ClNa + 2,3NaOH + 348H2O


6743
6743

Instalación de absorción
Para 1 kg de cloro absorbido por la sosa (y convertido en
hipoclorito sódico) son necesarios 4,45 kg de hiposulfito sódico ó 89 kg de
solución al 5%.
Además de las reacciones indicadas, hemos de tener en cuenta
otras que pueden suceder como consecuencia de la alta concentración del
hipoclorito, que se ha producido en la torre de absorción al reaccionar el
cloro con la sosa cáustica.
El hipoclorito sódico formado se puede descomponer de la
siguiente forma:
3ClONa = ClO3Na + 2ClNa (I)
2ClONa = 2ClNa + O2 (II)
La reacción (I) está fuertemente afectada por la temperatura y
el pH en la zona de contacto del cloro y la sosa cáustica.
Por otra parte cuando el hipoclorito sódico sigue sometiéndose a
cloración, se descompone formándose ClOH, según la reacción:
ClONa + Cl2 + H2O = 2ClOH + ClNa
(III)
y a
partir de este ClOH, la formación de clorato ocurrirá según la reacción:
2ClOH + ClONa = ClO3Na + 2ClH (IV)
La tasa de formación de clorato de la última reacción (IV) es
mayor que la formación según la reacción (I). A su vez el ClH formado en
(IV) se combina con el ión hipoclorito formando más ClOH y por tanto se
favorece más aún la formación de clorato.
Finalmente cabe indicar que si la reacción (II) de formación de
O2 es apreciable, el vapor de agua que puede generarse y el
propio oxígeno favorecerán la aparición de espumas que dificultarían la
absorción de cloro en la torre; el exceso de sosa cáustica evitará esta
situación.
FICHA DE
ALMACENAMIENTO DE CLORO
Valoración de la riqueza en NaOH de la
solución de sosa empleada para la neutralización del cloro
Considerando que recién adquirida o
preparada la solución de hidróxido sódico (sosa caustica) para la torre de
absorción de fugas de cloro es una solución exclusivamente de NaOH, tendrá
un alcalinidad a la fenolftaleina (TA) igual a la alcalinidad total al
naranja de metilo (TAC) y por tanto en una simple valoración con ácido 1 N,
el volumen de ácido gastado dividido por el volumen de solución de hidróxido
sódico tomado nos dará la normalidad y por tanto la concentración de esa
solución.
Ejemplo:
Si se toman 10 ml. De solución de hidróxido
sódico al 27 % recién preparada (suele ser la concentración inicial en el
depósito de la instalación de absorción de fugas de cloro) y se valora con
solución de ClH 1 N en presencia de fenolftaleina, se gastarán 67,5 ml de
ácido, por tanto la normalidad de la solución de sosa será 6,75 N y de aquí
se obtendría que la concentración en NaOH es 6,75 x 40 = 270 g./l. (40 es
el equivalente químico del NaOH).
A medida que pasa el tiempo y la torre de
absorción se va utilizando en la absorción de pequeñas fugas de cloro, la
riqueza en hidróxido sódico, es decir la alcalinidad cáustica libre, va
disminuyendo, ya que por un lado se forma hipoclorito sódico y por otro
lado hay una cierta carbonatación debido al CO2. En general casi
siempre será el TA mayor que ½ TAC y en este caso la alcalinidad puede ser
debida a hidróxidos y a carbonatos. La alcalinidad debida a hidróxidos será
2TA – TAC y la alcalinidad por carbonatos será 2(TAC – TA), es decir, la
alcalinidad por hidróxidos disminuirá a costa de ir aumentando la
alcalinidad por carbonatos.
Si el pH es < 9,4, no habrá hidróxido en la
solución y la alcalinidad puede deberse entonces a carbonatos y
bicarbonatos.
Ejemplo real de calculo de la concentración
en NaHO de una solución de sosa cáustica de una instalación de
neutralización de fugas de cloro después de haber pasado 30 días desde su
preparación con una concentración inicial del 27 %:
Se toma una muestra de de la solución,
obteniéndose los siguientes resultados:
pH = 13, 2
Valoración de 1 ml. de la muestra con ácido
1 N:
Con el indicador fenolftaleina (TA): 6,6 ml
(parte para neutralizar todos OH- y otra para reaccionar con ½
de los CO3= ).
Con el indicador naranja de metilo (TAC):
7,0 ml (parte para neutralizar todos los OH- y otra para
reaccionar con todos los CO3= )
De estas dos valoraciones se deduce que la
diferencia 7,0 ml – 6,6 ml = 0,4 ml son los empleados en valorar la mitad de
los carbonatos, por tanto 6,6 – 0,4 = 6,2 ml de ácido empleado en valorar
los hidróxidos (procedentes de la sosa), luego la riqueza de esta solución
de sosa será:
6,2 x 40 (eq. de la sosa cáustica) = 248 g /
litro, es decir 24,8 %
Nota: Si se toma una muestra de la solución
de la torre de absorción en la cual puede haber hipoclorito sódico, este se
deberá destruir previamente añadiendo a la muestra pequeñas cantidades de
agua oxigenada al 10 % hasta que cese la efervescencia y después se continúa
con la determinación de la alcalinidad.
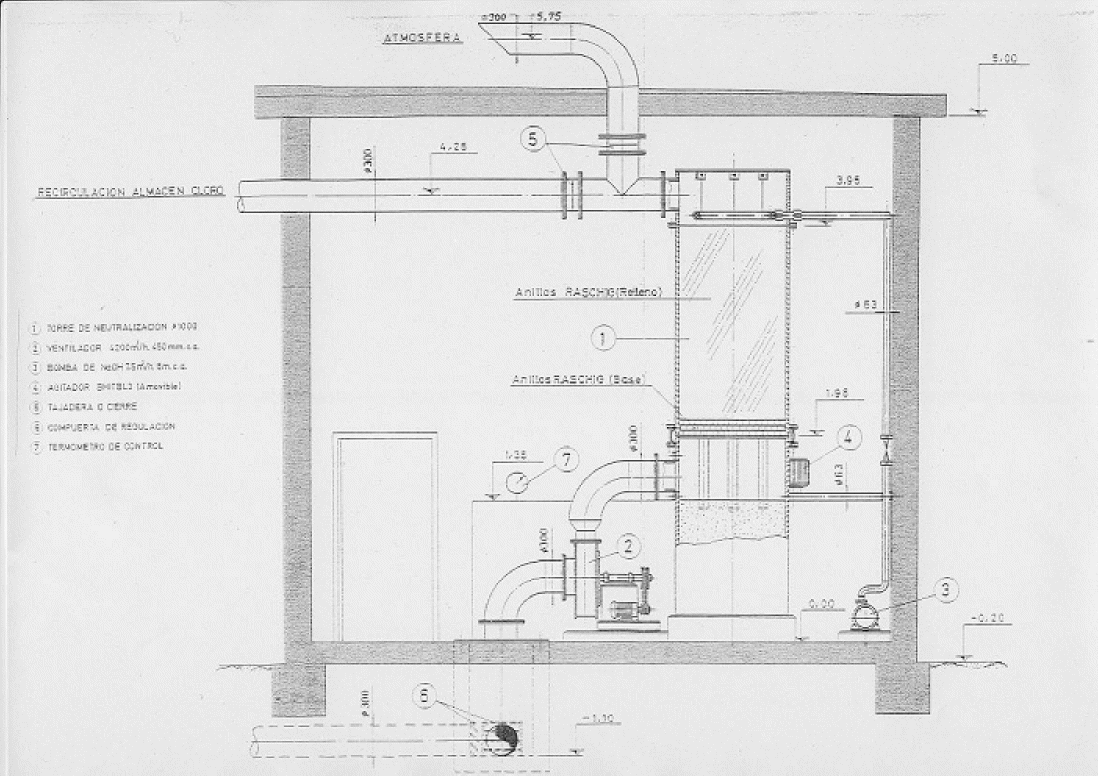
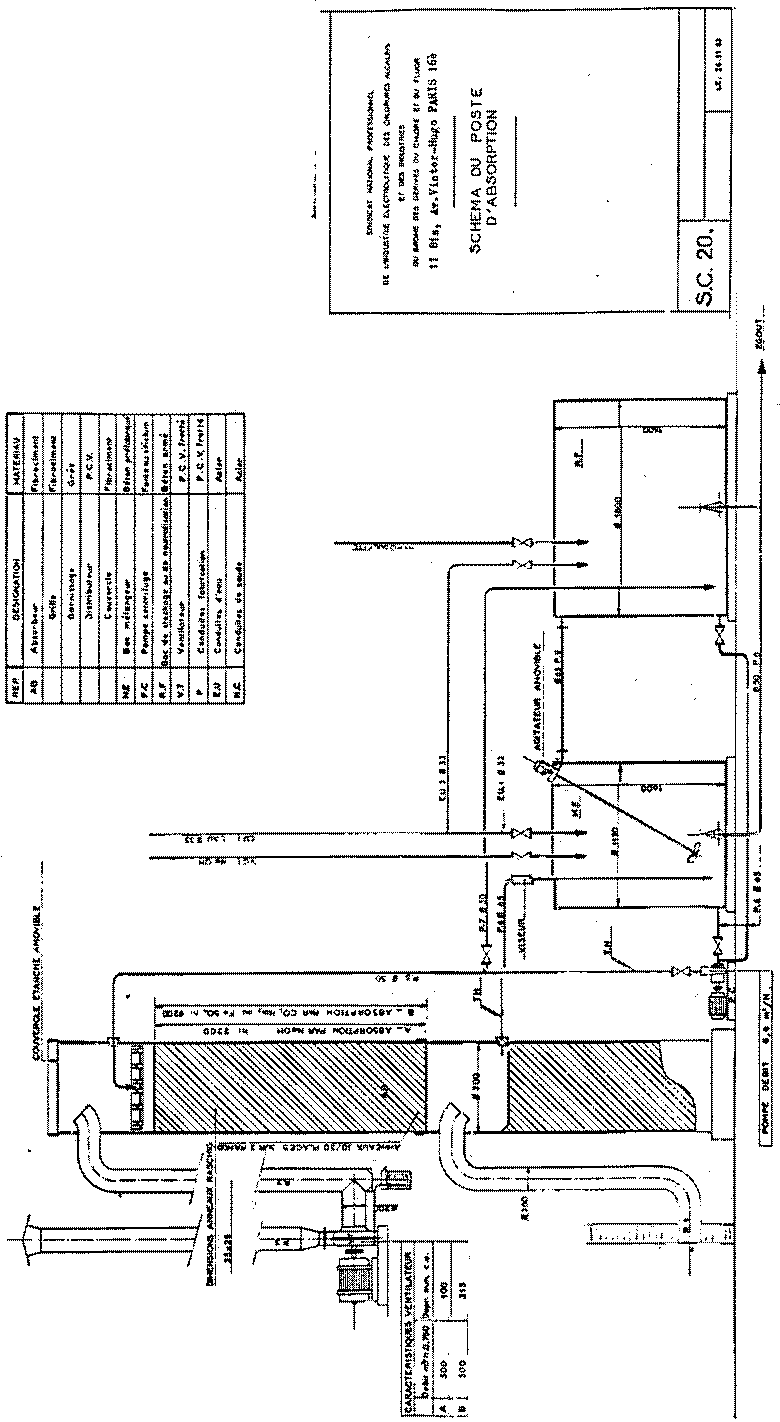
En
los esquemas siguientes, del Sindicato Nacional Profesional de la Industria
Electrolítica de Cloruros Alcalinos y de las Industrias del Bromo y
Derivados del Cloro y del Fluor, de Francia, se representan diversos
esquemas de una instalación de absorción y neutralización de cloro.

Ensayos de cloración
ANALISIS DE AGUAS Y
ENSAYOS DE TRATAMIENTO. Rafael Marín Galvín
Ensayos de
oxidación-desinfección ( De " Análisis de Aguas y ensayos de tratamiento" R.
Marin Galvín)
Generalidades
1, Existen en la
bibliografía multitud de referencias acerca de la utilidad práctica de los
distintos oxidantes químicos frente a problemas más o menos habituales de
contaminación de un agua. Se recomienda a este particular, y a fin de no ser
exhaustivo, la consulta de las referencias (3.8, 9, 14.323,
335.389.392, 393) .
Habida cuenta de los
variados reactivos que pueden aplicarse para desinfección y oxidación de un
agua vamos a estructurar separadamente los más habitualmente empleados:
cloro, ozono, ClO2 y KMnO4. Nótese, no obstante que el
procedimiento de todos estos ensayos es muy similar. A título informativo,
la tabla 16.3 recoge las dosis teóricas (según estequiometría)
necesarias para eliminar varias sustancias típicas por oxidación química.
16.5.1. Ensayos de
cloración
(a) Principio
La cloración de un agua,
proceso clásico de oxidación y desinfección, suele conseguir la eliminación
de cantidades discretas de Fe, Mn, amonio, nitritos, H2S y la
flora microbiana habitual de un agua bruta. El ensayo proporciona la dosis
de cloro para la cual, después de las reacciones correspondientes entre el
oxidante y las sustancias del agua, se obtiene una concentración de cloro
residual libre que pueda ser idónea para su aplicación en planta:
ésta suele ser de alrededor de 1 mg/l de Cl2 libre en agua
tratada (8, 9, 409).
Se trata, pues, de
adicionar cantidades crecientes de disolución de cloro de concentración
conocida a un agua problema y determinar la dosis necesaria para reducir el problema concreto que tenga el agua a testar. En concreto, la reacción más
típica de cloración es la experimentada por el amonio de un agua. En este
caso, el cloro adicionado va reaccionando en varios pasos con el amonio
hasta su eliminación total: primero se forman monocloraminas (CINH2),
después dicloraminas (Cl2NH). en tercer lugar tricloruro de
nitrógeno (Cl3N), para finalmente detectar cloro libre. Obsérvese
que en esta secuencia, se obtiene una curva de demanda de cloro no lineal.
Al principio, para
incrementos de dosis de cloro se producen ligeros incrementos en las
concentraciones de cloro residual debido a la formación de compuestos
aminados. En una segunda fase el cloro residual desciende (por destrucción
de los compuestos anteriores) hasta llegar a un punto, denominado punto de
ruptura o break-point a partir del cual, nuevos incrementos de cloro
añadido suponen efectivamente incrementos de cloro libre
( ver fig.16.2).
(b) Materiales y Reactivos
- Los recogidos para los
ensayos de jar-test (ap. 16.3).
- Disolución de cloro (en
realidad hipoclorito sódico) de riqueza conocida. Esta se obtiene mediante
la aplicación del método recogido en el Capítulo siguiente.
-Disolución de cloro de 1
mg/ml. Se prepara por dilución de la anterior. La adición de 1 ml a 1 l de
agua equivale a dosis industriales de 1 g/m3.
(c) Procedimiento
El test-cloro puede
realizarse sólo con disolución de cloro o bien adicionando posteriormente a
ésta la dosis óptima de coagulante y/o floculante obtenidas mediante
jar-tests anteriores. En este secundo caso se trata de un ensayo de test-
cloro completo, mientras en el primer caso sería un ensayo de test-cloro
simple.
- Llenar los vasos de
precipitados con 1 1 de agua problema. Poner el sistema en agitación rápida
(120 rpm).
- Añadir cantidades
crecientes de disolución de cloro de forma que se obtenga una secuencia
ascendente. Agitar 30 segundos a velocidad rápida.
- Opcionalmente, añadir las
dosis óptimas de coagulante y/o floculante. Agitar otros 30 segundos a
velocidad rápida.
- Mantener agitación lenta
(25 rpm) durante 10 minutos.
- Esperar 4 horas y
proceder a la lectura del cloro residual (ver el método de análisis recogido
después).
(d) Expresión de
Resultados
Se puede proceder a la
confección de una curva de demanda de cloro. representando gráficamente en
abcisas las dosis de cloro adicionadas y en ordenadas, las concentraciones
residuales obtenidas para cada dosis (para cada vaso).
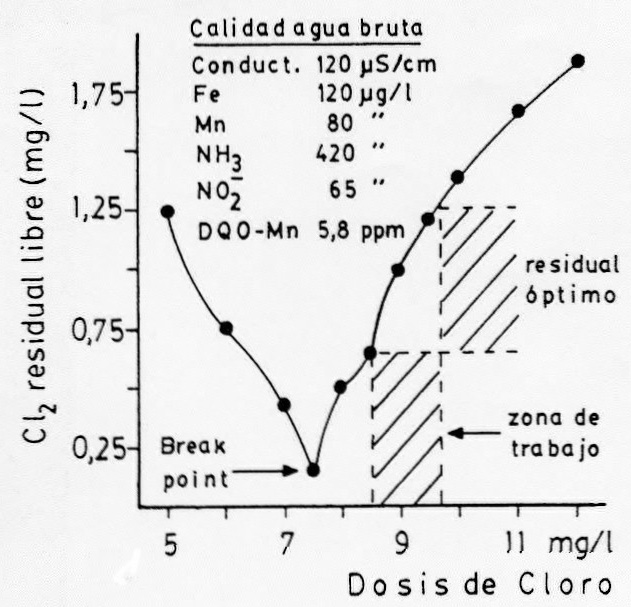
Figura 16.2: Curva práctica de
demanda de cloro
La dosis óptima del ensayo
será aquella que corresponda a un residual de alrededor de 1 mg/l de Cl2
residual libre, después del punto de ruptura. Está
suficientemente comprobado que un agua con estos contenidos de cloro libre
se encuentra razonablemente exenta de presencia microbiana en general (y
patógena en particular).
A título orientativo,
conocidas las concentraciones de Fe, Mn, nitrito, amonio y DQO-Mn se puede
estimar aproximadamente la dosis de cloro requerida por un agua, aplicando
las ecuaciones de la tabla 16.3. Además. cada mg/l de DQC-Mn consume
en términos generales 1 mg/l de cloro (296)
. Conocida la dosis aproximada, el ensayo deberá utilizar una serie dosis en
un intervalo que comprenda aquel valor. En el orden práctico, aguas brutas
de buena calidad suelen presentar demandas de cloro inferiores a 4-5 g/m3,
aguas de calidad media (contenidos moderados de Fe, amonio y DQO-Mn)
requieren hasta 10-12 g/m3, mientras aguas de mala calidad
exhiben demandas de cloro superiores a 20 g/m3.
Otras informaciones que
pueden extraerse de los ensayos del test-cloro son los relativos a las
concentraciones residuales de sustancias potencialmente oxidables presentes
en el agua, formación de trihalometanos. etc...
Determinación de cloro residual en aguas
(a) Principio
Se basa en la formación de
un complejo coloreado susceptible de medida colorimétrica entre el cloro
libre y el DPD, o N-N'dietil para-feniléndiamina en un medio tamponado [90,
205, 222].

Tabla 16.3 Reacciones típicas
de oxidación en tratamiento de aguas y dosis teóricas de oxidante para
eliminación de Fe, Mn y amonio.
La adición al medio de
reacción de un agente complejante de los cationes mayoritarios
presentes en el agua (AEDT) y de una sal de Hg eliminan interferencias del
método. Podría utilizarse además del recocido a continuación una valoración
con tiosulfato sódico en medio ácido similar a la que se expondrá para
determinar la riqueza de disoluciones comerciales de hipoclorito sódico (ver
Cap. 17).
Sin embargo, esta
titulación adolece del defecto de no poder especiar entre diferentes tipos
de sustancias doradas del agua.
(b) Materiales y
Reactivos
- Espectrofotómetro o
colorímetro capaz para medidas de absorbancia a 515 nm equipado con cubetas
de 1 cm de paso óptico.
- Material de vidrio de
laboratorio.
- Disolución tampón:
disolver 24 g de Na2HPO4 y 46 g de KH2PO4
en unos 500 ml de agua destilada. Añadir 800 mg de AEDT y 20 mg de HgCl2.
Disolver. Diluir hasta un total de 1.000 ml de disolución, con agua
destilada.
Disolución de DPD: disolver
1,0 g de oxalato de DPD ó 1,1 g de sulfato de DPD en unos 500 ml agua
destilada conteniendo 8 ml de H2SO4 (1:3) (v/v) y 200
mg de AEDT. Enrasar a 1.000 ml con agua destilada. Esta disolución guardada
en frasco oscuro permanece inalterable durante 2 meses. Se debe descartar
siempre que presente coloración o fenómenos de precipitación.
- Disoluciones patrón de
cloro. Se pueden preparar por dilución de una disolución patrón concentrada
de cloro de concentración conocida y valorada. Concentraciones comprendidas
entre 0.05 y 3 mg/l dan buenos resultados para la obtención de curvas de
calibrado prácticas.
(c) Procedimiento
- La curva de calibrado se
obtiene por adición a 10 ml de patrón de concentración conocida de 10 gotas
de disolución tampón y otras 10 gotas de disolución de DPD. Mezclar y anotar
la transmitancia (o absorbancia) como función de la concentración de cloro
en mg/l.
- Si el agua problema
presenta ligera coloración y/o turbidez, centrifugar a 5.000 rpm durante 5
minutos.
- A un tubo de ensayo
añadir 10 ml de agua problema.
- Añadir 10 gotas de
disolución tampón y mezclar por invers~on.
- Añadir 10 gotas de
disolución de DPD y mezclar por inversión. Inmediatamente tomar la lectura
en el colorímetro y anotar los mg/l de cloro "A".
- A la disolución anterior
añadir 0,1 mg de KI y mezclar por inversión. Inmediatamente anotar la
lectura en el colorímetro que serán "B" mg/l.
- A la disolución anterior
añadir 0.1 g de KI, mezclar para disolución y esperar 2 minutos. Anotar la
lectura en el colorímetro que corresponderá a "C" mg/l.
- A 10 ml de agua problema
sin adición de ningún reactivo, añadir 0.1 mg de KI y mezclar. Añadir
posteriormente, 10 gotas de disolución tampón y mezclar; añadir después
otras 10 gotas de disolución de DPD y mezclar. Obtener la medida inmediata
de cloro de la curva de calibrado que será "N" m/l.
(d) Expresión de
Resultados
En general, la lectura de
"'A" corresponderá al cloro libre residual del agua analizada. Las demás
lecturas permiten el cálculo de las diferentes formas de cloro residual
combinado del agua, si es que existieran. En este sentido, la tabla 16.4
permite determinar en mg/l los contenidos en Cl2 libre,
monocloramina. dicloramina y tricloruro de nitrógeno del agua. Existen en el
mercado colorímetros portátiles que facilitan la determinación rutinaria de
cloro en aguas. Estos aparatos ya vienen calibrados electrónicamente y
requieren un mínimo mantenimiento.
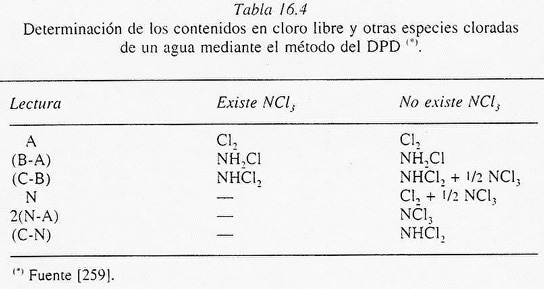
Tabla 16.4 Determinación de
los contenidos en cloro libre y otras especies cloradas de un agua mediante
el método del DPD (*).
A continuación se muestra la
ficha tecnica de seguridad química del cloro editada por el Instituto
Nacional de Seguridad e Higiene en el Trabajo

Real Decreto 656/2017, de 23 de junio, por el que se aprueba
el Reglamento de Almacenamiento de Productos Químicos y sus Instrucciones
Técnicas Complementarias MIE APQ 0 a 10
(Se señala aquí solo el Art. 5 )
Enlaces relacionados con cloración
Tratando
pozos con cloro. Mark L. McFarland, Profesor Asociado y Especialista de
Extensión en Fertilidad de Suelos
Monty C. Dozier, Profesor Asistente y Especialista de Extensión en Recursos
del Agua
El Sistema Universitario Texas A&M
R. Craig Runyan, Coordinador del Programa,Departamento de Ciencia de
Plantas,
Universidad Estatal de Nuevo México
Guia
básica para la e laboración rústica del cloro para potabilizar agua en áreas
rurales. Publicado por el Instituto Politecnico Nacional. Unidad
Politécnica para el Desarrollo y Competitividad Empresarial - México.
Cloro . Artículo de Keith A.Christman. Consejo de Química del Cloro.
Arlinton.VA.USA. Publicado en la página de Ingenieroambiental.com
Cloro .
Como se fabrica
THE
Chlorine Manual
Chlorine in water disinfection. Artículo de Hend Galai-Gorchev.
Organización Mundial de la Salud.
Sistemas de cloración
alternativos. Artículo de José T. Masis en la página de
Aguamarquet,
recogiendo una breve exposición sobre generadores de hipoclorito de sodio
in-situ.
Clorato en el
hipoclorito sódico
Tratando
agua almacenada con cloro.
Monty
C. Dozier, Mark L. McFarland,
El
Sistema Universitario Texas A&M
Cloración del agua potable.
A Review of
Disinfection Practices and Issues
Una revisión de las prácticas de desinfección y Asuntos.
Publicación de
www.waterandhealth.org
Canadian Chlorine Coordinating Committee
Euro Chlor
|